Arzneimittelforschung und -entwicklung
Arzneimittelforschung und -entwicklung
Kleine und große Moleküle sind im gesamten Prozess der Arzneimittelforschung und -entwicklung sowohl Treiber für die Zukunft von Pharma- und Biotechnologieunternehmen als auch eines der größten Risiken und Haftungsfelder. Falsche Entscheidungen in diesem Prozess können zu erheblichen Problemen führen, wie etwa hohen versunkenen Kosten, einem überlasteten klinischen Entwicklungspipeline, einer Fehlallokation von Personal und Ressourcen und sogar dem Rückzug des Produkts vom Markt im Falle schwerwiegender Folgen für die Patienten.
Arzneimittelentwickler konzentrieren daher einen Großteil ihrer Bemühungen darauf, die Attrition und Eliminierung von Kandidaten aus der Entwicklungspipeline bereits in frühen präklinischen Entwicklungsstadien zu erhöhen. Ziel ist es, so früh wie möglich entscheidende Informationen über die Sicherheit der verschiedenen Moleküle zu sammeln, relevante biologische Modelle zu verwenden und wertvolle Zeit und Ressourcen einzusparen.
Das 5R-Modell, das 2012 von AstraZeneca eingeführt wurde, zielt darauf ab, während der Arzneimittelforschung und -entwicklung die richtigen Entscheidungen zu treffen. Dabei werden der richtige Zielmechanismus („Right Target“), das richtige Gewebe („Right Tissue“), der richtige Patient („Right Patient“), die richtigen Sicherheitsprüfungen („Right Safety Tests“) und das richtige Modell („Right Model“) berücksichtigt.
Mit Hilfe dieses Modells gelingt es Pharma- und Biotechnologieunternehmen weltweit, die Erfolgsquote ihrer Arzneimittelkandidaten zu erhöhen, die Phase III der klinischen Entwicklung erreichen. Dies schafft neue Dynamik und eröffnet neue Chancen für Patienten.
Der Prozess der Arzneimittelentdeckung und -entwicklung
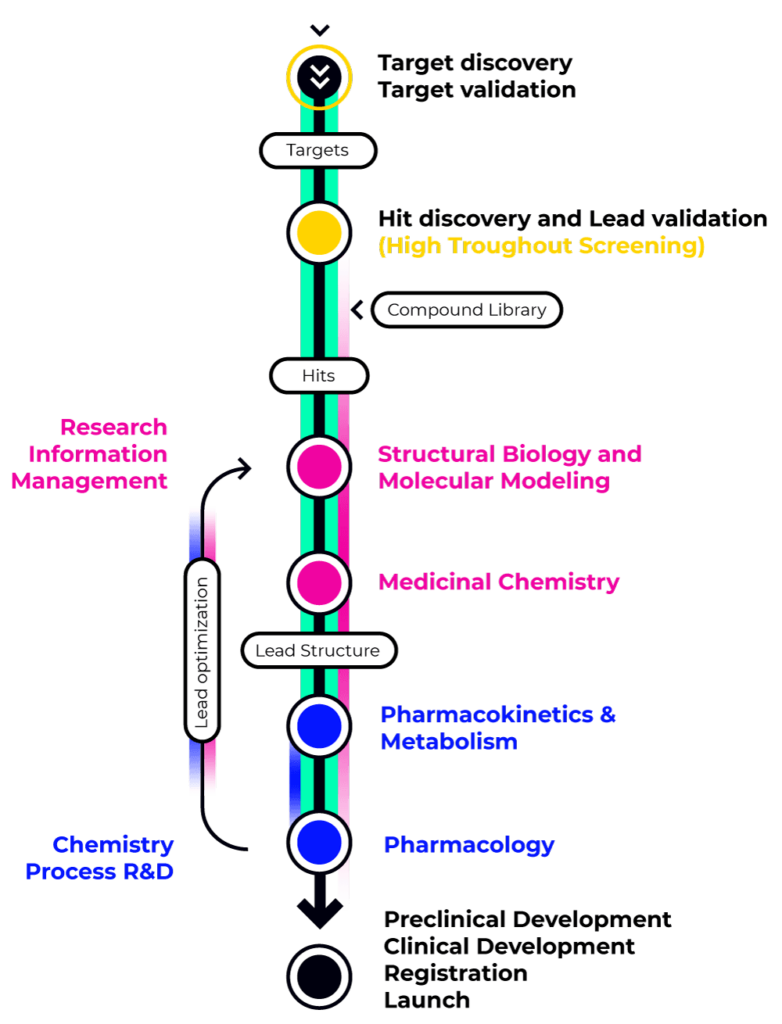
Der Prozess der Arzneimittelentdeckung und -entwicklung für sowohl kleine als auch große Moleküle beginnt mit einem tiefgehenden Verständnis der zu behandelnden Krankheit. Dabei kommen zwei Hauptstrategien zum Einsatz, abhängig davon, ob ein molekulares Ziel für die Behandlung identifiziert wurde.
Target-basierte Strategien zielen darauf ab, den Wirkmechanismus einer Krankheit zu bestätigen und ein geeignetes therapeutisches Ziel zu identifizieren. Dieses Ziel wird anschließend in einem Hochdurchsatz-Screening-Assay eingesetzt, um Moleküle zu identifizieren, die eine Wirkung zeigen (Hits). Diese Hits können anschließend zu einem Wirkstoffkandidaten (Lead) weiterentwickelt und optimiert werden, bis sie für präklinische und klinische Studien bereit sind.
Target-agnostische Strategien (phänotypisches Screening) konzentrieren sich hingegen darauf, präzise Krankheitsmodelle zu entwickeln und vorselektierte Verbindungen zu testen, um Kandidaten mit einer signifikanten biologischen Aktivität auszuwählen.
Während es für Entwickler von kleinen Molekülen entscheidend ist, enge Kooperationen zwischen den Abteilungen für Biologie, medizinische Chemie und ADME-Tox (Absorption, Distribution, Metabolism, Excretion und Toxikologie) sicherzustellen, müssen Entwickler von großen Molekülen zusätzlich die Aktivitäten der Zelllinienentwicklung, Proteinengineering sowie der CMC-Abteilung (Chemistry, Manufacturing, and Control) koordinieren, um eine effiziente und skalierbare Produktion zu gewährleisten.
Neue Herausforderungen in der Arzneimittelforschung und -entwicklung
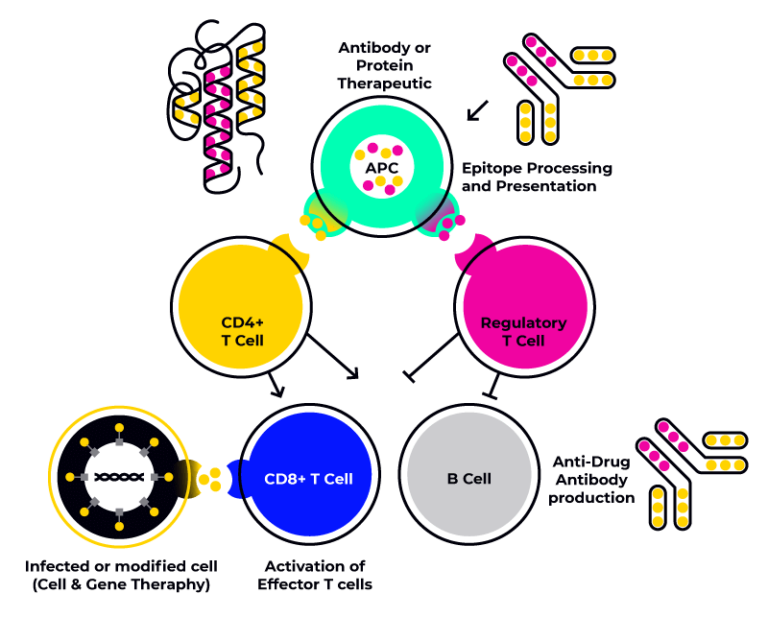
Die Immunogenität ist ein Mechanismus, der sowohl Zellen des angeborenen Immunsystems wie Monozyten, Makrophagen, NK-Zellen, Mastzellen und Neutrophile, als auch Zellen des adaptiven Immunsystems, wie Makrophagen, dendritische Zellen, T-Helferzellen, T-Zytotoxische Zellen, T-Regulatorische Zellen und B-Zellen, einbeziehen kann.
Das HLA-Profil eines Individuums stellt einen entscheidenden Faktor für die Immunantwort dar. Daher ist es notwendig, Zellen von Spendern mit einem HLA-Profil zu untersuchen, das repräsentativ für die Zielpopulation ist, um Immunogenitätsassays präzise entwickeln und durchführen zu können.
Die folgenden Herausforderungen sind zunehmend von Bedeutung und stellen eine wichtige Quelle für Besorgnis dar:
- Entwicklung von Assays zur frühzeitigen Erkennung von Sicherheitsbedenken
- Entwicklung neuer Assays zur Analyse von On- und Off-Target-Toxizität für Hersteller von Großmolekülen und ATMPs, die intrazelluläre Epitope auf HLAs ansprechen
- Entwicklung von Biomarkern und Companion Diagnostics zur Überwachung des Therapieverlaufs
- Diversifizierung der Entwicklungspipeline in Richtung neuer Modalitäten
- Etablierung relevanter komplexer biologischer Modelle, um eine reibungslose Translation präklinischer Daten in die klinische Anwendung zu gewährleisten
- Ausbau der Kapazitäten zur Untersuchung von Nebenwirkungen während der klinischen Entwicklung und Bereitstellung mechanistischer Erklärungen zur Optimierung laufender und zukünftiger Studien
- Sicherstellung operativer Flexibilität in der F&E, um Ressourcen auf vielversprechende neue Projekte zu lenken
- Aufbau von ergebnisorientierten Partnerschaften mit zuverlässigen Partnern, um Projekte termingerecht und im vorgegebenen Budgetrahmen abzuschließen
Wenn Sie sich durch eine dieser Herausforderungen angesprochen fühlen, vereinbaren Sie gerne eine kostenlose Beratung mit einem unserer Experten.
Unser Angebot für Drug Discovery und Development
BIOMEX ist ein führender Anbieter im Bereich Life Sciences und unterstützt Pharma- und Biotechnologieunternehmen bei ihren Forschungs- und Entwicklungsprozessen im Rahmen der Wirkstoffentdeckung und -entwicklung.
Unser aktuelles Portfolio für Drug Discovery und Development umfasst:
Unsere Expertise für Life Science
Entfalten Sie das volle Potenzial Ihrer Forschung mit unseren hochwertigen Bioproben und erstklassigen Dienstleistungen. Bei BIOMEX sind wir davon überzeugt, dass die enge Zusammenarbeit mit unseren Kunden der Schlüssel ist, um den Erfolg von Projekten zu maximieren, Kosten zu senken und Entwicklungszeiten zu verkürzen.