Zelluläre Ausgangsmaterialien
Primärzellen für Zell- und Gentherapie
Frische und kryokonservierte Primärzellen werden in der Forschung und Prozessentwicklung von Zell- und Gentherapien eingesetzt. Sie dienen entweder als Ziel der Therapie in Wirksamkeits- und Potenzstudien, als Immunassays in Sicherheitsstudien oder als Ausgangsmaterial für die Prozessentwicklung, Herstellung und Schulung.
Unabhängig von Ihrem Entwicklungsstadium: Planen Sie Ihre Experimente mit wissenschaftlicher Präzision und setzen Sie diese mit BIOMEX erfolgreich um!
Erfahren Sie, wie BIOMEX Sie dabei unterstützen kann, Ihre Therapie von der Entdeckung bis zur klinischen Anwendung zu bringen, die Markteinführungszeit zu verkürzen und Ihr Entwicklungsvorhaben abzusichern.
Materialien für die Zell- und Gentherapie: Forschung und Prozessentwicklung
Donorvariabilität, Versorgungssicherheit, Workflow-Flexibilität und die Qualität biologischer Materialien gehören zu den zentralen Herausforderungen für Entwickler von Zell- und Gentherapien in den Phasen der Forschung und Prozessentwicklung. BIOMEX beschafft und liefert seine Produkte aus eigenen Plasmazentren und Produktionsstätten in Mitteleuropa und gewährleistet so die Einhaltung hoher Qualitätsstandards entlang der gesamten Lieferkette – von der Isolation bis zur Lieferung.
Während frische Materialien häufig in den späten Phasen der Forschung und Prozessentwicklung eingesetzt werden, da sie die klinischen Bedingungen am besten widerspiegeln, bieten kryokonservierte Zellen eine ideale Grundlage für frühe Forschungsphasen. Sie ermöglichen eine höhere Flexibilität und Reproduzierbarkeit im experimentellen Design bei kleineren Maßstäben. Ebenso schaffen kryokonservierte Leukopaks mehr Planbarkeit in der Prozessentwicklung, da sie die Experimentplanung von den logistischen Anforderungen frischer Materialien entkoppeln.
Erfahren Sie mehr über:
Frische Leukopaks
Frische Leukopaks entstehen durch einen Zellkonzentrationsprozess, der auf der Blutspende gesunder und freiwillig zustimmender Spender basiert (Leukapherese) und gemäß einem durch die Ethikkommission (IRB) genehmigten Protokoll durchgeführt wird. Frische Leukopaks können als Ausgangsmaterial für die Isolierung spezifischer Immunzelltypen verwendet werden, die anschließend kryokonserviert und in der Entdeckungsphase oder als Ausgangsmaterial für die Prozessentwicklung eingesetzt werden. Die Konzentration von Leukozyten in der Leukapherese ist höher als in Vollblut, und die Konzentration von mononukleären Zellen (MNCs) ist höher als in Buffy Coats (typische Zusammensetzung: bis zu 20 % Monozyten, 50 % T-Zellen, 10 % B-Zellen, 10 % natürliche Killerzellen und 3 % Granulozyten).
Die Isolierung einzelner Zelltypen aus Leukopaks ermöglicht eine hohe Zellausbeute und reduziert die donorabhängige Variabilität zwischen Experimenten. Dennoch ist zu berücksichtigen, dass individuelle Spendermerkmale wie Alter, Körpergröße, Geschlecht, BMI, Rauchgewohnheiten oder eine spezifische Krankengeschichte die Assay-Performance und das Verhältnis der Zellbestandteile beeinflussen können. Eine Erhöhung der Spenderdiversität in Studien kann die Prozessrobustheit in späten Entwicklungsphasen verbessern und wertvolle Erkenntnisse über Ausreißer liefern. Falls Sie daran interessiert sind, mehr Spenderdiversität in Ihre Sicherheitsstudien einzubinden, besuchen Sie unsere Seite zu Immunogenität – Immuntoxizität oder kontaktieren Sie uns direkt.
Frische Leukopaks enthalten mindestens 10 Milliarden Zellen (Ganz-Leukopak) bzw. 5 Milliarden Zellen (Halb-Leukopak) bei der Freigabe. Wir legen jedoch besonderen Wert auf schnelle Lieferung und hohe Produktqualität. Daher gewähren wir bei Abweichungen von mehr als 5 % von der angegebenen Mindestzellzahl automatisch einen Rabatt auf eine Tasche der nächsten Bestellung.
Frische Leukopaks werden direkt von BIOMEX in den unternehmenseigenen Plasmazentren in Deutschland isoliert und können innerhalb von 24 Stunden nach der Isolierung in ganz Zentraleuropa geliefert werden. Nach der Isolierung erhalten Sie einen Tracking-Link mit Informationen zu Protokollen, Analysezertifikaten und weiteren relevanten Details. Zu den Parametern im Analysezertifikat gehören demografische Daten und Spenderinformationen, HLA-Typisierung, Blutbild sowie Erregernachweise auf Spenderniveau. Zusätzliche Tests können auf Anfrage durchgeführt werden.
Für Informationen zu Lieferzeiten bei spezifischen Spenderanforderungen, der Möglichkeit einer erneuten Spenderauswahl oder der Lieferung in Länder außerhalb Zentraleuropas kontaktieren Sie bitte unser Vertriebsteam.
Kryokonservierte Leukopaks
Kryokonservierte Leukopaks entstehen durch einen Zellkonzentrationsprozess, der mit dem Blut gesunder und einwilligender Spender (Leukapherese) gemäß einem IRB-geprüften Protokoll beginnt. Anschließend erfolgt ein kontrollierter kryokonservierender Einfrierschritt. Kryokonservierte Leukopaks können als Ausgangsmaterial für die Isolation spezifischer Immunzelltypen genutzt werden, die weiter kryokonserviert und in der Entdeckungsphase oder als Ausgangsmaterial für die Prozessentwicklung eingesetzt werden können. In diesem Zusammenhang sind kryokonservierte Leukopaks besonders für die Prozessentwicklung geeignet, da sie eine Entkopplung des experimentellen Plans von der Logistik des Rohmaterials ermöglichen. So können Experimente flexibel gestartet und wertvolle Zeit sowie Ressourcen eingespart werden.
Die Konzentration von Leukozyten in der Leukapherese ist höher als in Vollblut, und die Konzentration von mononukleären Zellen (MNCs) ist höher als in Buffy Coats (typische Konzentrationen: bis zu 20 % Monozyten, 50 % T-Zellen, 10 % B-Zellen, 10 % natürliche Killerzellen und 3 % Granulozyten). Die Zellviabilität und die Zellzahlen der verschiedenen Zellpopulationen sind bei frischen und kryokonservierten Leukopaks vergleichbar und werden im Analysezertifikat dokumentiert.
Die im Analysezertifikat aufgeführten Parameter umfassen demografische Daten und Spenderinformationen, HLA-Typisierung, ein vollständiges Blutbild sowie Tests auf Pathogene auf Spenderniveau. Auf Wunsch können bei neuen Produktionen zusätzliche Tests hinzugefügt werden.
Für Informationen zu individuellen Lieferzeiten für spezifische Spenderanforderungen, die Möglichkeit, einen bestimmten Spender erneut zu kontaktieren, oder zur Lieferung in Länder außerhalb Mitteleuropas kontaktieren Sie uns bitte direkt.
PBMCs (periphere mononukleäre Blutzellen)
PBMCs (Peripheral Blood Mononuclear Cells) sind eine Untergruppe der peripheren Blutzellen, zu denen T- und B-Lymphozyten, natürliche Killerzellen (NK-Zellen), Monozyten und dendritische Zellen gehören. Sie werden häufig als Ausgangsmaterial zur Isolierung spezifischer Zellsubpopulationen verwendet, die in unterschiedlichen Assays eingesetzt werden können.
PBMCs werden aus Leukopaks durch Dichtegradientenzentrifugation isoliert und anschließend kryokonserviert, nachdem eine Zellzählung durchgeführt wurde. Die Zellen werden in leicht überhöhter Anzahl abgefüllt, um mögliche Zellverluste während der Kryokonservierung auszugleichen und sicherzustellen, dass die in den Spezifikationen angegebenen Mindestwerte für lebensfähige Zellen erfüllt werden. Nach dem Einfrieren werden die PBMCs aufgetaut, um eine Qualitätskontrolle durchzuführen. Dabei werden die Zellviabilität sowie die Zellanzahl überprüft.
BIOMEX isoliert PBMCs aus Leukopaks, die in den firmeneigenen Plasmazentren gewonnen werden, und kann eine Kryokonservierung innerhalb von 2 Stunden nach der Entnahme gewährleisten. Dies führt zu hochwertigen, nicht stimulierten PBMCs, die in großen Chargen erhältlich sind, um eine optimale Konsistenz über mehrere Experimente hinweg zu garantieren.
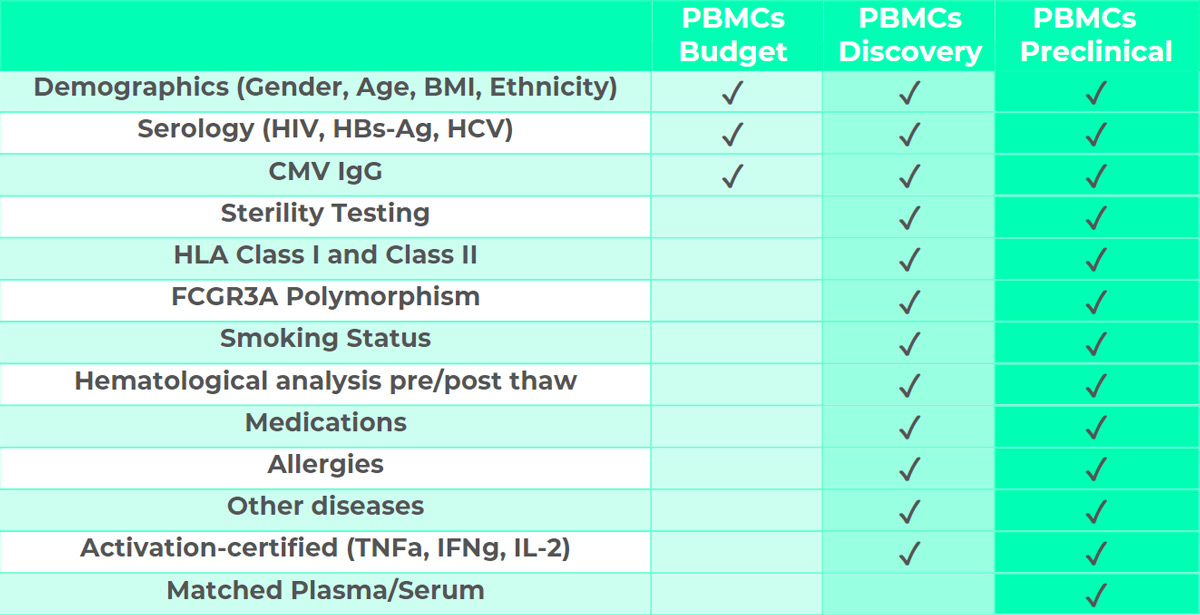
BIOMEX PBMC-Pläne
Dieser Plan richtet sich an Grundlagenforschung und eignet sich ideal für Vorstudien oder Assays, die keine erweiterten Spenderinformationen erfordern. PBMCs-Budget-Zellen werden serologisch getestet. Zusätzliche Informationen und Tests können gegen eine geringe Gebühr gemäß dem unten aufgeführten Plan bereitgestellt werden.
Dieser Plan ist für Assays konzipiert, die in der Arzneimittelentwicklung eingesetzt werden, einschließlich Target-Validierung, Lead-Identifikation und Optimierung. Es werden vollständige Spenderinformationen bereitgestellt, darunter Demografie, Serologie, HLA-Klasse-I- und -II-Charakterisierung, FCGR3A-Polymorphismen, Rauchstatus, hämatologische Analysen vor und nach dem Auftauen, Medikation, Allergien sowie gegebenenfalls andere Erkrankungen. PBMCs-Discovery-Zellen werden auf Sterilität und Zellaktivierung getestet.
Dieser Plan ist für Assays im Bereich der präklinischen Forschung vorgesehen, einschließlich Immunogenitäts-, Immunotoxizitäts-, mechanistischer Toxikologie- und explorativer Toxikologie-Assays. PBMCs-Preclinical werden mit umfassenden Spenderinformationen geliefert, darunter Demografie, Serologie, HLA-Klasse-I- und -II-Charakterisierung, FCGR3A-Polymorphismen, Rauchstatus, hämatologische Analysen vor und nach dem Auftauen, Medikation, Allergien sowie gegebenenfalls andere Erkrankungen. Zusätzlich sind passendes Plasma oder Serum vom gleichen Spender in 1-ml-kryokonservierten Aliquots verfügbar.
Unser Angebot für Sicherheitsprüfungen in der Zell- und Gentherapie
Die Sicherheitsprüfung von Zell- und Gentherapien stellt einen der wichtigsten Schritte während der präklinischen und klinischen Entwicklung dar. Während sich adoptive Zelltherapien (ACTs), darunter T-Zell-Rezeptor-modifizierte T-Zellen (TCR-T), chimäre Antigenrezeptor-T-Zellen (CAR-T) und tumorinfiltrierende Lymphozyten (TIL), als äußerst effektiv in der Krebstherapie erwiesen haben, sind sie mit milden bis lebensbedrohlichen Nebenwirkungen wie On-Target-Toxizität, Off-Target-Toxizität und durch Immunaktivierung hervorgerufenen Toxizitäten, wie dem Zytokinfreisetzungssyndrom (CRS), assoziiert. Ebenso wurde bei Gentherapien von On- und Off-Target-Toxizität berichtet. Insbesondere bei Adeno-assoziierten Viren (AAV) haben die hohen Dosen an viralen Vektoren, die notwendig sind, um die Grundproduktion von gegen Kapsidproteine gerichteten Antikörpern zu überwinden, zu schwerwiegenden unerwünschten Ereignissen wie Hepatotoxizität und einer Toxizität der dorsalen Wurzelganglien geführt.
Unser Angebot im Bereich der Sicherheitsprüfungen für Zell- und Gentherapien umfasst PBMC-Panels für Immunogenitäts- und Immunotoxizitätstests, mit oder ohne dazugehöriges Plasma und Serum. Wenn Sie Zeit und Ressourcen sparen möchten, steht Ihnen unser erfahrenes Serviceteam zur Seite, um den Fortschritt Ihrer Pipeline zu beschleunigen.
Immunogenitäts- und Immunotoxizitätspanels
Die Immunogenitäts- und Immunotoxizitätspanels von BIOMEX wurden entwickelt, um die hausinternen Sicherheitsprüfungen von Biologika, Zelltherapien und Gentherapien während der präklinischen und klinischen Phasen zu unterstützen. Die Panels sind so konfiguriert, dass sie die häufigsten HLA-Klasse-I- und -Klasse-II-Allele der kaukasischen Bevölkerung abdecken und somit für erste Screening-Assays geeignet sind. Panels für spezifischere Assays mit besonderen Allelen können auf Anfrage zusammengestellt werden.
Die Immunogenitäts- und Immunotoxizitätspanels enthalten jeweils 100 Kryoröhrchen, entsprechend 10 Röhrchen à 20 Millionen lebensfähige, kryokonservierte PBMCs (pro Röhrchen/Spender) von insgesamt 10 Spendern. Die kryokonservierten PBMCs werden auf Sterilität und Serologie, Zellaktivierung sowie ihre Leistungsfähigkeit in einem T-Zell-Proliferationsassay und einem DC:T-Zell-Stimulationsassay getestet. Demografische Daten, frühere Krankheitsgeschichten sowie hämatologische Analysen vor und nach dem Auftauen sind auf Anfrage verfügbar.
Verfügbare Panels:
Dieses Panel umfasst 10 verschiedene Spender und wurde so zusammengestellt, dass es die häufigsten HLA-Klasse-I-Allele der kaukasischen Bevölkerung abdeckt. Es enthält häufig auch einige der selteneren Allele. ImmunoSafe™-HLA1-Panels sind als Standardprodukte ab Lager für die Lieferung am nächsten Tag verfügbar. Sollte das Panel nicht auf Lager sein, beträgt die Lieferzeit bis zu 3 Wochen. Informationen zur Verfügbarkeit spezifischer Panelzusammensetzungen erhalten Sie bei unserem Vertriebsteam.
Dieses Panel umfasst 10 verschiedene Spender und wurde so zusammengestellt, dass es die häufigsten HLA-Klasse-II-Allele der kaukasischen Bevölkerung abdeckt. Es enthält häufig auch einige der selteneren Allele. ImmunoSafe™-HLA2-Panels sind als Standardprodukte ab Lager für die Lieferung am nächsten Tag verfügbar. Sollte das Panel nicht auf Lager sein, beträgt die Lieferzeit bis zu 3 Wochen. Informationen zur Verfügbarkeit spezifischer Panelzusammensetzungen erhalten Sie bei unserem Vertriebsteam.
Erfahren Sie mehr über unsere Immunogenitäts- und Immunotoxizitäts-Angebote:
Passendes Plasma und Serum
Passendes Plasma und Serum sind auf Anfrage von Spendern verfügbar, die in die ImmunoSafe™-Panels eingebunden sind, und werden in 1-ml-Aliquots bereitgestellt. Für kundenspezifische Panels und Neuproduktionen beträgt die Lieferzeit bis zu 3 Wochen. Für Informationen zur Lieferzeit spezifischer Panelzusammensetzungen oder zu anderen Aliquotformaten kontaktieren Sie uns bitte.