Immunogenität und Immunotoxizität
Immunogenität und Immunotoxizität
Immunogenität und Immunotoxizität stellen potenzielle Herausforderungen bei der Entwicklung neuer Biotherapeutika, Impfstoffe sowie Zell- und Gentherapien dar. Diese Themen stehen daher im Fokus intensiver Studien und Diskussionen seitens der Regulierungsbehörden und der wissenschaftlichen Gemeinschaft.
Unter Immunogenität versteht man die Fähigkeit einer Substanz, eine Immunantwort auszulösen. Immunotoxizität hingegen bezeichnet die Fähigkeit einer Substanz, schädliche Wirkungen im Immunsystem oder anderen Körpersystemen hervorzurufen, die durch eine Fehlfunktion des Immunsystems bedingt sind.
Welche Rolle spielen Immunogenität und Immunotoxizität bei der Entwicklung neuartiger Proteintherapeutika?
Die Bewertung von Immunogenität und Immunotoxizität bei neuartigen Proteintherapeutika spielt eine zentrale Rolle, um deren Sicherheit und Wirksamkeit zu gewährleisten. Dabei stehen Entwickler vor diversen Herausforderungen, wie den Variationen immunologischer Reaktionen zwischen unterschiedlichen Bevölkerungsgruppen, den altersbedingten Veränderungen der Immunogenität von Impfstoffen sowie der generellen Eignungslosigkeit von Tiermodellen zur Vorhersage von Immunantworten beim Menschen.
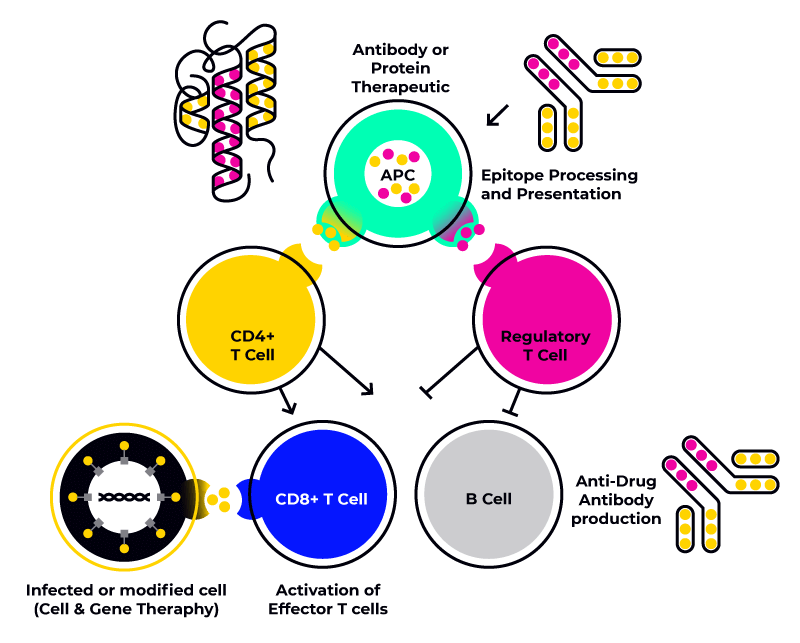
Während Immunotoxizität in der Regel eine unerwünschte Nebenwirkung therapeutischer Ansätze darstellt, kann Immunogenität sowohl eine gewünschte als auch eine unerwünschte Wirkung bei neuartigen Proteintherapeutika sein:
- Gewünschte Immunogenität ist ein zentraler Aspekt der Wirksamkeit von Impfstoffen. Durch die Injektion des gewünschten Antigens wird eine gezielte Immunantwort ausgelöst, die einen Schutz gegen den aktiven Krankheitserreger aufbaut.
- Unerwünschte Immunogenität bezeichnet hingegen eine ungewollte Immunreaktion gegen Proteintherapeutika. Diese führt häufig zur Bildung von Anti-Drug-Antikörpern (ADAs), die inaktivierenden oder neutralisierenden Eigenschaften gegenüber dem Therapeutikum aufweisen können.
Aufgrund der potenziellen Risiken unerwünschter Immunogenität erwarten regulatorische Behörden, dass Entwickler von nicht-vakzinenbasierten Biologika validierte Immunogenitätsassays einsetzen, um das Risiko der ADA-Bildung in den klinischen Entwicklungsphasen zu erkennen und zu charakterisieren.
Während der präklinischen Bewertung von Immunogenität und Immunotoxizität kann eine frühzeitige Charakterisierung der angeborenen und adaptiven Immunantwort gegen neuartige Proteintherapeutika dazu beitragen, Entwicklungsrisiken zu minimieren. Darüber hinaus können dabei wertvolle Einblicke in den Wirkmechanismus sowie Hinweise zur Patientensegmentierung in den klinischen Phasen gewonnen werden.
Was sind die Mechanismen der Immunogenität?
Immunogenität ist ein Mechanismus, der sowohl Zellen des angeborenen Immunsystems, wie Monozyten, Makrophagen, NK-Zellen, Mastzellen und Neutrophile, als auch Zellen des adaptiven Immunsystems, wie Makrophagen, dendritische Zellen, T-Helferzellen, zytotoxische T-Zellen, regulatorische T-Zellen und B-Zellen, involviert. Ein wichtiger Einflussfaktor auf die Immunantwort ist das HLA-Profil eines Individuums. Daher ist es unerlässlich, Zellen von Spendern mit einem HLA-Profil zu untersuchen, das die Zielpopulation repräsentiert, um Immunogenitäts-Assays präzise zu entwickeln.
Immunogenität in Biotherapeutika
Genau dieser zweite, HLA-Klasse-II-vermittelte Mechanismus führt zur Bildung von Anti-Drug-Antikörpern (ADAs), was sowohl eine reduzierte Wirksamkeit von Biotherapeutika als auch andere unerwünschte Ereignisse wie Überempfindlichkeitsreaktionen und eine erhöhte Clearance des therapeutischen Produkts zur Folge hat.
Da T-Zell-Rezeptoren (TCRs) den HLA-Epitop-Komplex erkennen, lässt sich nachvollziehen, warum bestimmte HLA-Allele eine Rolle bei der Entwicklung von ADAs bei Patienten mit Multipler Sklerose und rheumatoider Arthritis spielen. Aus diesem Grund ist es wichtig, Biotherapeutika mit einer repräsentativen Probe von Immunzellen (z. B. peripheren mononukleären Blutzellen, PBMCs) zu testen, die die häufigsten HLA-Klasse-II-Allele oder Haplotypen (eine Gruppe von Allelen, die gemeinsam von einem Elternteil vererbt werden) der Zielpopulation präsentieren.
Ein solches Screening ermöglicht eine frühzeitige Identifikation potenzieller Immunogenitätsrisiken und trägt dazu bei, die Sicherheit und Wirksamkeit von Biotherapeutika für die jeweilige Zielgruppe zu gewährleisten.
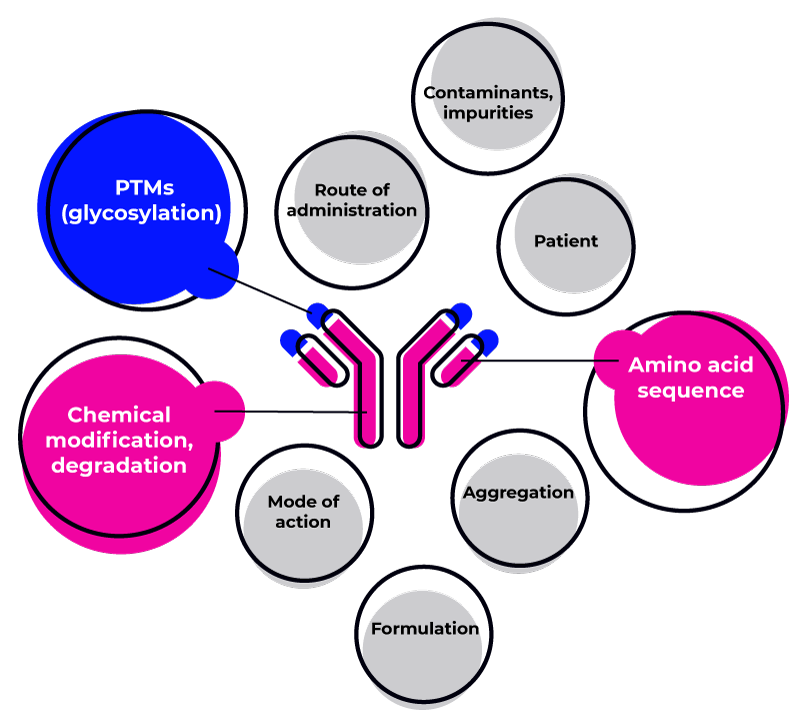
Häufige Ursachen für Immunogenität umfassen:
-
Die HLA-Allele des Patienten
-
Die Aminosäurestruktur des Biotherapeutikums
-
Mögliche Aggregation des Biotherapeutikums
-
Chemische Modifikationen oder Abbauprozesse
-
Der Verabreichungsweg
-
Mögliche Vorerkrankungen des Patienten
-
Verunreinigungen und Kontaminationen
-
Formulierung und Dosierung
-
Der Wirkmechanismus (z. B. intra- oder extrazelluläre Zielstrukturen)
-
Posttranslationale Modifikationen (PTMs) wie Glykosylierung und PEGylierung
-
Das Vorhandensein von Komponenten tierischen Ursprungs
-
Das Vorhandensein tierischer Sequenzen in der Struktur des Biotherapeutikums
Die Bewertung der Immunogenität eines Biotherapeutikums kann bereits in der präklinischen Entwicklungsphase erfolgen. Dies geschieht durch eine in silico-Analyse der Epitope im Biotherapeutikum, eine zellbasierte Untersuchung der ausgewählten Epitope auf Immunzellen, die die häufigsten HLA-Klasse-II-Varianten abdecken, sowie durch in vitro-Immunogenitätsassays, die Antikörperbindung und neutralisierende Reaktionen vorhersagen.
Während der klinischen Entwicklung kann das Vorhandensein von Anti-Drug-Antikörpern (ADAs) durch validierte Nachweisverfahren in Blutproben von Patienten bestätigt werden.
Immunogenität in Zell- und Gentherapien sowie Impfstoffen
Während die adaptive Immunantwort, die durch HLA-Klasse-II-Moleküle vermittelt wird, eine zentrale Rolle bei der Entwicklung von Immunogenität gegen Biotherapeutika (unerwünschte Immunogenität) und Impfstoffe (erwünschte Immunogenität) spielt, ist die HLA-Klasse-I-vermittelte Immunantwort entscheidend für die Entwicklung von Zell- und Gentherapien sowie Impfstoffen.
Zelltherapien umfassen Anwendungen, bei denen Zellen expandiert und geschädigtem Gewebe wieder zugeführt werden. Bei allogenen Zelltherapien ist zu berücksichtigen, dass Unterschiede in den polymorphen Regionen endogener Proteine des Spenders oder die Expression unterschiedlicher HLA-Allele dazu führen können, dass neue Epitope auf HLA-Klasse-I-Molekülen präsentiert werden. Diese werden daraufhin von NK-Zellen oder CD8+ T-Zytotoxischen Zellen eliminiert.
Gentherapien sind Anwendungen, bei denen Zellen entweder in vivo oder ex vivo genetisch modifiziert werden. Analog zu Arzneimitteln für neuartige Therapien (ATMPs), bei denen genetische Manipulationen an autologen oder allogenen Zellen durchgeführt werden, können neue Sequenzen und/oder Epitope eingeführt werden. Diese neu gebildeten Epitope werden ebenfalls von HLA-Klasse-I-Molekülen präsentiert und potenziell von NK-Zellen oder CD8+ T-Zytotoxischen Zellen eliminiert.
Obwohl die Immunantwort auf Impfstoffe zu einem großen Teil von der durch HLA-Klasse-II vermittelte adaptive Immunantwort abhängt, um neutralisierende Antikörper zu generieren, ist die Aktivierung von CD8+ T-Zytotoxischen Zellen verantwortlich für die Eliminierung infizierter Zellen bei viralen und anderen intrazellulären Pathogenen. Dies stoppt die Infektion. mRNA-Impfstoffe haben sich während der COVID-19-Pandemie als wesentliche Methode zur Bekämpfung von Infektionen erwiesen und sich als schnell entwickelbare Impfstoffplattform gegen eine Vielzahl von Pathogenen etabliert. Ihre Wirksamkeit beruht darauf, dass pathogenabgeleitete Antigene in den Zellen der geimpften Person exprimiert werden. Daher ist die Überwachung der HLA-Klasse-I-vermittelten Immunantwort entscheidend, um einerseits einen ausreichenden Schutz gegen den Erreger sicherzustellen und andererseits Toxizitäten an der Injektionsstelle zu vermeiden, die durch die CD8+ T-Zytotoxische Antwort auf antigenexprimierende Zellen des Impfstoffs hervorgerufen werden können.
Es ist daher essenziell, die Immunogenität von Zell- und Gentherapien sowie Impfstoffen zu bewerten, indem sie an Immunzellen getestet werden, die die am häufigsten in der Zielpopulation vorkommenden HLA-Klasse-I-Moleküle repräsentieren.
Welche Assays werden für die Immunogenitätsprüfung verwendet?
Die Entwicklung von Biotherapeutika, Biosimilars, Zell- und Gentherapien sowie Impfstoffen erfordert eine umfassende Analyse des Immunogenitätsrisikos sowohl des Wirkstoffs als auch des Endprodukts. Die Bewertung des Immunogenitätsrisikos basiert auf einer Vielzahl von Assays, die dazu beitragen, das Auftreten und die Ursachen der Immunogenität in Ihrem therapeutischen Ansatz zu verstehen und die optimale Strategie zu entwickeln.
Zu den gängigen Assays für die präklinische Bewertung der Immunogenität gehören:
-
In-silico-Epitop-Analysen
-
In-vitro-Bindungsassays für HLA-Klasse-I- und HLA-Klasse-II-Moleküle
-
Zellbasierte Immunogenitätsassays, einschließlich T-Zell-Proliferationsassays, DC:T-Zell-Stimulations- und Proliferationsassays sowie 2D- und 3D-Migrations- und Aktivierungsassays in komplexen Modellen
-
In-vivo-Immunogenitätsbewertung mit humanisierten Mausmodellen
-
Ex-vivo-Assays mit Plasma oder Vollblut zur Detektion anti-drug antibodies (ADA)
Was sind die Mechanismen der Immunotoxizität?
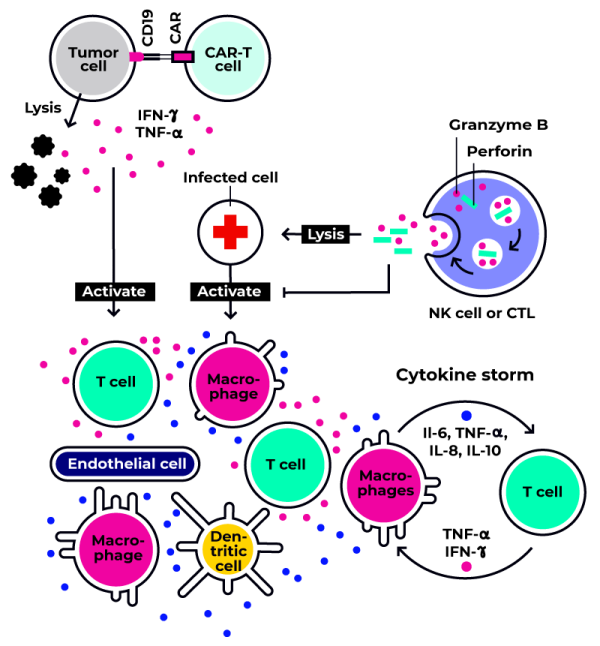
Immunotoxizität beschreibt die Fähigkeit einer Substanz, die humorale oder zelluläre Immunantwort zu beeinträchtigen. Dies kann zu Immunsuppression führen oder unnötige Gewebeschäden verursachen, wie im Falle von Überempfindlichkeitsreaktionen, Autoimmunität oder chronischen Entzündungen. Immunotoxizität wird in on-target– und off-target-Immunotoxizität unterteilt.
Immunomodulatory therapies as well as immune-based ATMPs such as CAR-T Cell Therapies are known to potentially induce CRS as a consequence of cell damage on- and off-target. It is therefore important to monitor the possibile occurence of immunotoxic effects in order to implement appropriate strategies during early development.
Die on-target-Immunotoxizität wird häufig durch immunmodulatorische monoklonale Antikörper (mAb) hervorgerufen. Sie resultiert aus einer übermäßigen oder verlängerten Aktivität des Antikörpers, der an das gewünschte Zielantigen oder die Zielzelle/-mediator bindet. Dies kann zur Modulation eines Ziels führen, das mehrere immunologische Funktionen hat, darunter auch solche ohne therapeutischen Nutzen, und somit Nebenwirkungen hervorrufen.
Die off-target-Immunotoxizität tritt häufig auf, wenn mAb Epitopen erkennen, die von nicht-immunologischen Zellen oder anderen Zellen exprimiert werden, die nicht als therapeutische Ziele vorgesehen sind.
Das Zytokinfreisetzungssyndrom (CRS) stellt eine der schwerwiegendsten Folgen der Immunotoxizität dar und kann potenziell tödliche Auswirkungen haben. CRS entsteht durch eine sogenannte Zytokinsturm-Reaktion, die als Folge einer normalen Immunantwort gegen Pathogene oder fremde Substanzen ausgelöst wird. Während dieser Reaktion setzen aktivierte Makrophagen und dendritische Zellen Zytokine frei, um Lymphozyten zu rekrutieren und die Entzündungsprozesse einzuleiten.
Welche Assays werden für die Immunotoxizitätstests verwendet?
Die Immunotoxizität ist eine der zentralen Überlegungen während der Auswahl von Leitstrukturen (Lead Selection) und der anschließenden Optimierung. Eine frühzeitige Bewertung von On- und Off-Target-Toxizitäten ist von entscheidender Bedeutung, um den Entwicklungsprozess zu entlasten und Risiken zu minimieren. Um die Immunotoxizität einer therapeutischen Strategie zu untersuchen, ist es essenziell, deren Wirkmechanismus zu verstehen und das klinisch akzeptable Risiko-Nutzen-Verhältnis für die Patient*innen abzuwägen.
Gängige Assays zur Bewertung der Immunotoxizität umfassen:
-
In-silico-Epitopanalysen: Vorhersage potenzieller immunogener Epitopbereiche mithilfe computergestützter Methoden.
-
Zellbasierte Off-Target-Toxizitätsbewertung mit primären Zellen aus nicht-zielgerichteten Geweben: Untersuchung unerwünschter Effekte auf Gewebe, die nicht das Ziel der Therapie sind.
-
Zellbasierte On-Target-Toxizitätsbewertung von CRS (Cytokinfreisetzungssyndrom): Analyse potenzieller Überreaktionen des Immunsystems auf die Therapie.
-
In-vivo-Studien (abhängig von der Pharmakologie): Untersuchung der Immuntoxizität in geeigneten Tiermodellen, wenn erforderlich.
-
Ex-vivo-Assays mit Plasma oder Vollblut zur Detektion von ADAs (Anti-Drug Antibodies): Überprüfung der Bildung von Antikörpern gegen das Therapeutikum.
Immunogenitäts- und Immunotoxizitätspanels
Die Immunogenitäts- und Immunotoxizitätspanels von BIOMEX wurden entwickelt, um die hausinterne Sicherheitsprüfung von großen Molekülen, Zelltherapien und Gentherapien während der präklinischen und klinischen Phasen zu unterstützen. Die Panels sind so konfiguriert, dass sie das gesamte Spektrum der häufigsten HLA-Klasse-I- oder Klasse-II-Allele in der kaukasischen Bevölkerung abbilden und sich ideal für erste Screening-Assays eignen. Panels zur Durchführung spezifischerer Assays mit besonderen Allelen können auf Anfrage zusammengestellt werden.
Die Immunogenitäts- und Immunotoxizitätspanels umfassen jeweils 100 Vials, bestehend aus 10 Vials à 20 Millionen lebensfähige kryokonservierte PBMCs/Vial/Spender für 10 Spender. Die kryokonservierten PBMCs werden auf Sterilität, Serologie und Zellaktivierung getestet und vorab in einem T-Zell-Proliferationsassay sowie einem DC:T-Zell-Stimulationsassay auf ihre Leistung überprüft. Auf Anfrage können Daten zu Demografie, klinischer Vorgeschichte und hämatologischen Analysen vor/nach dem Auftauen bereitgestellt werden.
Folgende Panels sind verfügbar:
Dieses Panel enthält 10 verschiedene Spender, die so zusammengestellt sind, dass sie die häufigsten HLA-Klasse-I-Allele in der kaukasischen Bevölkerung abdecken, und enthält oft auch einige der weniger häufigen Allele. ImmunoSafe™-HLA1-Panels sind als Standardprodukte erhältlich und können am nächsten Tag geliefert werden. Falls das Panel nicht auf Lager ist, beträgt die Lieferzeit bis zu 3 Wochen.
Dieses Panel enthält 10 verschiedene Spender, die so zusammengestellt sind, dass sie die häufigsten HLA-Klasse-II-Allele in der kaukasischen Bevölkerung abdecken, und enthält oft auch einige der weniger häufigen Allele. ImmunoSafe™-HLA2-Panels sind als Standardprodukte erhältlich und können am nächsten Tag geliefert werden. Falls das Panel nicht auf Lager ist, beträgt die Lieferzeit bis zu 3 Wochen.
Um die Lieferzeit für spezifische Panelzusammensetzungen zu erfragen, kontaktieren Sie uns bitte.
Gepaarte Plasma- und Serumproben
Gepaarte Plasma- und Serumproben sind auf Anfrage von Spendern verfügbar, die in ImmunoSafe™-Panels aufgenommen wurden, in 1-ml-Aliquots.
Immunogenitäts- und Immunotoxizitäts-Dienstleistungen
Unsere Dienstleistungen im Bereich Immunogenität und Immunotoxizität sind darauf ausgelegt, Ihnen umfassende Informationen zum Risikoprofil Ihres therapeutischen Kandidaten bereitzustellen. Sie ermöglichen es Ihnen, Ihr Biotherapeutikum weiter zu verfeinern, zu humanisieren oder zu optimieren sowie dessen Potenz und Wirksamkeit zu bewerten.
Unsere Strategie
Wir setzen auf in silico- und in vitro-Assays, um immunogene Epitope zu identifizieren, die Interaktion von Immunzellen zu untersuchen und geeignete Kandidaten auszuwählen.
Von BIOMEX entwickelte in vitro-Assays umfassen:
-
T-Zell-Aktivierung und -Proliferation
-
Aktivierung und Proliferation angeborener Immunzellen
-
DC:T-Zell-Stimulations-Assays
-
Cytokinsturm-Assay
Wenn Sie an der Entwicklung neuer Assays oder der Untersuchung spezifischer Wirkmechanismen interessiert sind, wird unser Serviceteam eng mit Ihnen zusammenarbeiten, um die optimale Lösung zu entwickeln.
Für weitere Informationen zur Risikominimierung in der Entwicklung Ihres Therapeutikums: