FAQ Diagnostik
Häufig gestellte Fragen:
BIOMEX Performance Evaluation Studies
Wir sind Ihre Experten für Performance Evaluation Studies im Bereich der In-vitro-Diagnostik und der Assay-Validierung. Nachfolgend finden Sie Antworten auf häufig gestellte Fragen zu diesen Themen. Für weitere Anliegen zögern Sie bitte nicht, uns direkt zu kontaktieren.
1. Hintergrund und Expertise
Unsere Hauptstandorte befinden sich in Heidelberg, Deutschland, einem der führenden biologischen Forschungszentren Europas. Heidelberg liegt nur eine Stunde mit dem Auto oder der Bahn vom größten deutschen Flughafen in Frankfurt am Main entfernt.
Einige unserer Alleinstellungsmerkmale, die uns von anderen CROs abheben und uns die Durchführung Ihrer Performance Evaluation Studies mit maximaler Flexibilität und Qualität ermöglichen, sind:
- Probengewinnung in unseren eigenen Spendezentren – prospektiv und exakt auf Ihre spezifischen Anforderungen abgestimmt
- Europas größtes kommerzielles Bioprobeninventar
- 100 % der Wertschöpfungskette im eigenen Haus, einschließlich:
- Fachkundige regulatorische Unterstützung
- Studienplanung
- Ethikgenehmigungen
- Tests in unseren eigenen Laboren
- Materialhandling
- Management externer Standorte
Seit 2017 führen wir Performance Evaluation Studies für In-vitro-Diagnostika durch. Seither haben wir zahlreiche Hersteller bei der Durchführung von Hunderten solcher Studien unterstützt.
90 % der Proben stammen aus unseren eigenen Spendezentren in Heidelberg, München und Kamerun (Afrika). Unser Inventar umfasst über 600.000 Bioproben: Plasma, Serum, Abstriche und Gewebe. Weitere Informationen finden Sie in unserem Sampleshop. Zusätzlich beziehen wir regelmäßig Restproben über unser weltweites Netzwerk und führen bei Bedarf prospektive Probenkollektionen für Sie durch.
Wir betreiben Laboratorien, die Arbeiten mit Proben der Biosicherheitsstufe 3 ermöglichen. Dazu gehören beispielsweise Proben von HIV, HCV oder SARS-CoV-2.
Neben Standardlaborverfahren bieten wir eine Vielzahl von Tests an, darunter PCR, Klinische Chemie, CLIA/CMIA, POCT und weitere. Unser Equipment umfasst:
| Company | Instrument |
|---|---|
| Roche | Cobas e411 |
| Roche | Cobas c501 |
| Roche | Cobas 5800 |
| Abbott | Architect i1000SR |
| Diasorin | Liason XL |
| BioMérieux | MiniVidas |
| ThermoScientific | Quantstudio 5 |
| Bio-Rad | CFX96 (x2) |
Selbstverständlich. Wir verfolgen eine „Open-Door-Policy“ und freuen uns, Ihnen unsere Infrastruktur vor Ort zu zeigen.
2. Leistungsbewertungsstudien
Neben klinischen und analytischen Leistungsstudien können Sie mit uns auch die Bewertung von patientennahen Testverfahren (Near-Patient Testing, NPT) bzw. Point-of-Care-Tests (POCT), Selbsttests für Laien sowie CLIA-Assays durchführen.
| Study Types | How we work |
|---|---|
| Clinical performance evaluation studies | We operate our own donation centers. This enables the sourcing of positive and negative samples for the evaluation of diagnostic sensitivity and specificity, as well as for the majority of common analytes. |
| Analytical performance evaluation studies | We perform full validation studies for IVDs (qualitative or quantitative) according to the relevant CLSI guidelines. This includes analytical sensitivity (limit of detection, limit of quantification), analytical specificity, stability of the assay or sample, trueness, precision, accuracy, linearity, measuring range, and cut-off value. |
| Laymen studies, Near-patient testing / Point-of-care testing | Through our own test centers, we can effectively recruit lay people to participate in usability/laymen studies or NPT/POCT studies. |
| Studies for the validation of CLIA-assays | Our infrastructure is capable of performing tests with class D IVDs (e.g., HIV) as well as class C and B IVDs in accordance with the EU common specifications. We have dedicated facilities and instruments for reference testing to routinely perform these validation studies in-house. |
Ja, im Gegensatz zu vielen anderen Auftragsforschungsinstituten (CROs) bieten wir einen umfassenden Full-Service an. Dieser umfasst das Studiendesign, alle damit verbundenen Fachberatungen durch unsere Experten, die Beschaffung und Aufbereitung aller notwendigen Proben, die Durchführung der Tests in unseren eigenen Laboren sowie die Datenanalyse und Erstellung des Abschlussberichts.
Bitte wenden Sie sich an unser Vertriebsteam unter sales@biomex.de. Unsere Experten führen Sie durch unseren standardisierten Anfrageprozess.
Die Studiendauer hängt von verschiedenen Faktoren ab, z. B. von der Art der Studie und der Probe, dem Stichprobenumfang, dem für die Probengewinnung erforderlichen Zeitraum (z. B. durch Inzidenzen und saisonale Ereignisse bei prospektiven Sammlungen), der Dauer der Ethikvotum-Einholung sowie dem zeitlichen Aufwand für das Studien-Setup. Dank unserer langjährigen Erfahrung können wir Ihnen in der Regel vorab eine fundierte Schätzung geben.
Grundsätzlich führen wir keine eigenständige Forschung zur wissenschaftlichen Validität durch, es sei denn, dies ist Bestandteil eines Gesamtpakets, das wissenschaftliche Validität, analytische Leistungsbewertung und klinische Leistungsbewertung umfasst.
Ja, zusätzlich zu unserer umfangreichen Biobank mit retrospektiv gesammelten Proben verfügen wir über die erforderliche Infrastruktur zur Gewinnung frischer Humanproben. Dies umfasst die Rekrutierung von Studienteilnehmenden sowie die Einholung der erforderlichen Ethikvoten durch eine Ethikkommission (IRB).
Je nach Studienanforderung können die üblichen klinischen Informationen der Spender erfasst werden, z. B. Alter, Geschlecht, Zeitpunkt/Datum der Probenentnahme, Erstdiagnose, Symptome und Symptombeginn, Angaben zu Kontaktpersonen und/oder Impfstatus, ICD-Code (sofern dies nicht gegen Anonymisierungsanforderungen verstößt). Eine prospektive Sammlung nicht anonymisierter Proben ist ebenfalls möglich – unter Einbindung klinischer Kooperationspartner und nach Vorlage eines positiven Ethikvotums.
Wir sind ein verlässlicher Partner für Zulassungsanträge gemäß IVDR (Europäische Union), TGA (Australien), NMPA (China) sowie den Richtlinien der WHO. Studien – insbesondere klinische – für FDA-Zulassungen (USA) bieten wir nicht an.
Wir beraten nicht direkt bei der Auswahl einer Benannten Stelle, vermitteln Sie jedoch gerne an einen unserer vertrauenswürdigen Partner weiter. Bitte wenden Sie sich hierzu an sales@biomex.de.
Wir agieren nicht als gesetzlicher Bevollmächtigter, stellen aber gerne den Kontakt zu einem unserer vertrauensvollen Partner her. Bitte kontaktieren Sie uns unter sales@biomex.de.
3. Qualität und Ethik
Unsere Geschäftstätigkeit orientiert sich an den Anforderungen unserer Kunden sowie an den geltenden gesetzlichen Vorgaben und wird durch unsere Verantwortung gegenüber Gesellschaft und Umwelt geleitet. Wir entwickeln und liefern qualitativ hochwertige Produkte auf dem neuesten Stand von Wissenschaft und Technik und bieten einen umfassenden Service. Grundlage unseres Handelns sind Zuverlässigkeit und Kundenorientierung. Unser Ziel ist die Fehlervermeidung anstelle nachträglicher Fehlerkorrektur. Die Anforderungen unseres Qualitätsmanagementsystems werden konsequent erfüllt, und wir verbessern dessen Wirksamkeit kontinuierlich. Weitere Informationen zu unserer Unternehmensphilosophie finden Sie auf unseren Unternehmensseiten.
Unser Qualitätsmanagementsystem ist nach ISO 9001 zertifiziert. Sämtliche Studien werden gemäß ISO 20916:2019 und ISO 14155 durchgeführt. Darüber hinaus befinden wir uns aktuell im Zertifizierungsprozess nach ISO 17025 für unsere Laboratorien.
Ja, sowohl für invasive als auch für nicht-invasive klinische Probenentnahmen.
Für nicht-invasive Testungen liegt eine Ethikgenehmigung für Teilnehmer ab 14 Jahren vor. Für invasive Testungen besteht eine Genehmigung ab 18 Jahren. Sollte eine Ethikfreigabe für jüngere Teilnehmer erforderlich sein, kann diese im Bedarfsfall beantragt werden.
Neben standardisierten Laborverfahren bieten wir eine Vielzahl diagnostischer Methoden an, darunter PCR, klinische Chemie, CLIA/CMIA, POCT und weitere. Unsere Laborausstattung umfasst unter anderem:
| Company | Instrument |
|---|---|
| Roche | Cobas e411 |
| Roche | Cobas c501 |
| Roche | Cobas 5800 |
| Abbott | Architect i1000SR |
| Diasorin | Liason XL |
| BioMérieux | MiniVidas |
| ThermoScientific | Quantstudio 5 |
| Bio-Rad | CFX96 (x2) |
Auftragsforschungsinstitut (CRO) für diagnostische Produkte?
Unsere Leistungen zeichnen sich unter anderem durch folgende Aspekte aus, die uns von anderen CROs unterscheiden und eine Durchführung Ihrer Leistungsbewertungsstudie mit höchster Flexibilität und Qualität ermöglichen:
- Probengewinnung in unseren eigenen Spendezentren – prospektiv und exakt auf Ihre individuellen Anforderungen zugeschnitten
- Europas größtes kommerzielles Biospezimen-Archiv
100 % der Wertschöpfungskette im eigenen Haus, einschließlich regulatorischer Expertise, Studiendesign, Ethikvoten, Labortests, Materialhandling und Management externer Studienzentren
Selbstverständlich. Wir pflegen eine „Open-Door-Policy“ und zeigen Ihnen unsere Infrastruktur gerne vor Ort.
4. In-vitro-Diagnostika-Verordnung (IVDR)
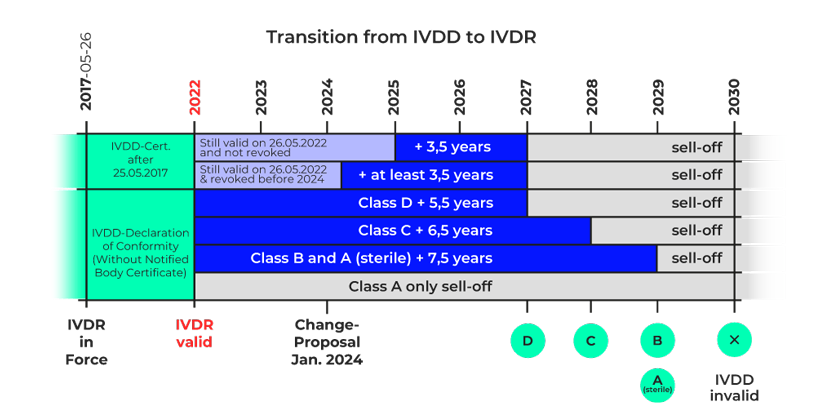
Die europäische In-vitro-Diagnostika-Verordnung (IVDR) trat im Mai 2017 in Kraft und ersetzte nach einer Übergangsfrist von fünf Jahren im Mai 2022 die bisher geltende In-vitro-Diagnostika-Richtlinie (IVDD). Bis Mai 2027 werden die Vorgaben der IVDR schrittweise für die jeweiligen Risikoklassen der Produkte verbindlich.
Die wissenschaftliche Validität bezeichnet den Zusammenhang zwischen einem Analyten und einem bestimmten klinischen Zustand oder physiologischen Zustand (IVDR, Artikel 2 (38)).
Die analytische Leistung beschreibt die Fähigkeit eines Produkts, einen spezifischen Analyten korrekt nachzuweisen oder zu messen (IVDR, Artikel 2 (40)).
Die klinische Leistung bezieht sich auf die Fähigkeit eines Produkts, Ergebnisse zu liefern, die mit einem bestimmten klinischen Zustand oder physiologischen bzw. pathologischen Prozess oder Zustand korrelieren (IVDR, Artikel 2 (41)).
Zur Beurteilung der Leistungsfähigkeit eines Produkts vor dem Inverkehrbringen müssen Hersteller alle verfügbaren Daten zum Produkt, zu dessen bestimmungsgemäßer Verwendung und zur Sicherheit erfassen und bestehende Datenlücken schließen. Offene Fragestellungen erfordern die Durchführung geeigneter Leistungsbewertungsstudien (IVDR, Anhang XIII, Teil A, Abschnitt 1.2).
Nach dem Inverkehrbringen sollen Hersteller systematisch Leistungs- und wissenschaftliche Daten aus der tatsächlichen Anwendung des Produkts erfassen und bewerten. Ziel ist es, die Sicherheit, Leistungsfähigkeit und wissenschaftliche Validität des Produkts über dessen gesamte Lebensdauer hinweg zu gewährleisten sowie potenzielle Risiken frühzeitig zu erkennen (IVDR, Anhang XIII, Teil B, Abschnitt 4).
Ihre Experten für diagnostische Studien
Möchten Sie Ihren Assay so schnell wie möglich auf den Markt bringen? Wir unterstützen Sie dabei – mit unserer langjährigen Erfahrung in der Validierung diagnostischer Assays, umfassender regulatorischer Expertise, einem umfangreichen Bestand an hausinternen Biomaterialien sowie unseren eigenen Spendezentren.